En 2025, seulement 12 nouveaux génériques autorisés ont été approuvés aux États-Unis - un chiffre en chute libre par rapport aux 37 de 2022. Pourtant, ces médicaments restent une option précieuse pour les patients qui ont besoin d’une exactitude thérapeutique totale. Contrairement aux génériques classiques, les génériques autorisés ne contiennent aucune différence dans la formule : même principe actif, mêmes excipients, même fabrication. La seule différence ? L’étiquette et l’emballage.
Qu’est-ce qu’un générique autorisé ?
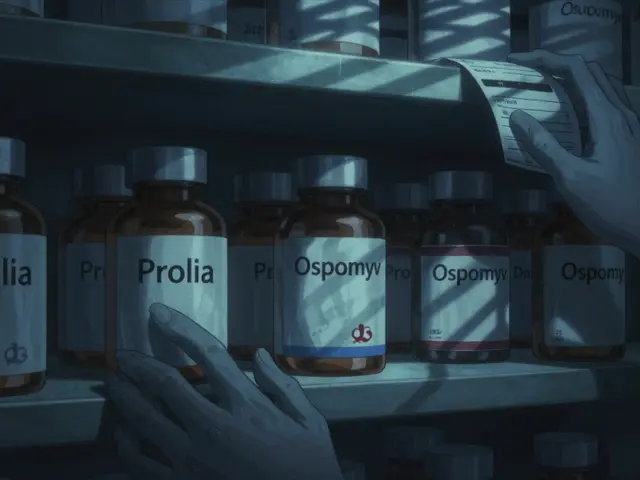
Un générique autorisé, c’est le médicament de marque, mais vendu sous un autre nom. Il est produit par le même laboratoire qui fabrique la version originale, parfois même sur la même ligne de production. Par exemple, si vous prenez Prolia (denosumab), une version identique peut être distribuée sous le nom Ospomyv - mais elle n’est pas un générique traditionnel. C’est un générique autorisé. La FDA le définit comme un médicament approuvé sous une demande de nouveau médicament (NDA), mais commercialisé avec un nom, un code ou un emballage différent. Il n’a pas besoin de prouver son efficacité ou sa bioéquivalence. Il est déjà le même produit.
Les génériques classiques, eux, doivent passer par une demande abrégée (ANDA) et peuvent contenir des excipients différents. Un patient stable sur un médicament de marque peut parfois ressentir des effets secondaires mineurs en passant à un générique classique - une réaction aux colorants, aux liants ou aux conservateurs. Mais avec un générique autorisé, ce risque disparaît. Une étude de 2024 publiée dans JAMA Internal Medicine montre que 15 à 20 % des patients restent fidèles à un générique autorisé dans les six mois suivant son lancement, contre seulement 8 à 12 % pour les génériques traditionnels. Pourquoi ? Parce qu’ils n’ont pas eu à s’adapter à une formule différente.
Les deux nouveaux génériques autorisés approuvés en octobre 2025
La dernière mise à jour de la liste officielle de la FDA, publiée le 10 octobre 2025, n’a ajouté que deux nouveaux génériques autorisés :
- Sodium oxybate (sous le nom commercial Xyrem), commercialisé par Jazz Pharmaceuticals avec un nouvel emballage et un nouveau nom de marque.
- Plecanatide (sous le nom commercial Trulance), distribué par Ironwood Pharmaceuticals sous une étiquette différente.
Ces deux produits ne sont pas des nouveautés thérapeutiques - ce sont des versions identiques de médicaments déjà sur le marché depuis plusieurs années. Mais ils sont importants pour les patients qui ont déjà eu des problèmes avec les génériques classiques. Par exemple, certains patients souffrant de narcolepsie avec cataplexie dépendent de Xyrem pour dormir. Même une petite variation dans les excipients peut perturber leur sommeil. Le générique autorisé leur permet de garder la même formule, mais à un prix inférieur.
Pourquoi les génériques autorisés sont-ils en déclin ?
La baisse des approbations n’est pas due à un manque de demande. C’est une question de stratégie et de pression réglementaire. La Federal Trade Commission (FTC) a intensifié ses investigations contre les pratiques de « pay-for-delay » - où les laboratoires de marque paient les fabricants de génériques pour retarder leur entrée sur le marché. Dans certains cas, les laboratoires créaient leur propre générique autorisé pour contrer la concurrence, ce qui bloquait les génériques indépendants. En 2023, Teva a dû payer 1,2 milliard de dollars pour avoir utilisé cette stratégie avec Copaxone.
Depuis, les grands laboratoires ont changé de tactique. Au lieu de lancer un générique autorisé, ils préfèrent maintenant développer des biosimilaires. En 2025, cinq biosimilaires interchangeables de Stelara (ustekinumab) ont été approuvés - mais aucun générique autorisé. Pourquoi ? Parce que les biosimilaires sont plus rentables à long terme, et la loi sur les produits biologiques (BPCIA) leur offre un cadre clair. Les génériques autorisés, eux, restent un outil de niche, utilisé uniquement pour des médicaments à indice thérapeutique étroit - où la moindre variation peut avoir des conséquences.

Le problème du prix : moins cher, mais pas assez
Les génériques autorisés sont souvent 10 à 15 % moins chers que le médicament de marque. C’est moins qu’un générique classique, qui peut coûter jusqu’à 80 % moins. Ce déséquilibre explique pourquoi les assureurs préfèrent les génériques traditionnels. En mai 2025, un patient sur Reddit a rapporté que son assurance Blue Cross a supprimé la couverture du générique autorisé de Jardiance - non pas parce qu’il était moins efficace, mais parce que le gestionnaire de prestations pharmaceutiques (PBM) avait négocié de meilleures remises sur le générique classique.
Sur Drugs.com, les avis sur le générique autorisé de Lyrica (pregabalin) sont très positifs : 68 % des utilisateurs disent qu’il est « identique » à la version de marque. Mais 78 % ajoutent : « Il n’est que 5 $ moins cher que le médicament original. » Pour beaucoup, ce n’est pas suffisant pour justifier le changement, surtout si leur assurance couvre déjà un générique classique à 10 $.
La confusion chez les pharmaciens
Un problème majeur : les génériques autorisés ne sont pas clairement identifiés. Un pharmacien ne peut pas les distinguer visuellement d’un générique classique. Une enquête de l’American Pharmacists Association en 2025 a révélé que 63 % des pharmaciens ne savent pas reconnaître un générique autorisé sans consulter le livre Orange de la FDA. Résultat ? 22 % des patients reçoivent des conseils inutiles sur la substitution - alors qu’avec un générique autorisé, aucune substitution n’est nécessaire. Il s’agit du même produit.
Des écoles de pharmacie, comme celle du Community College of Philadelphia, ont maintenant intégré un module de trois heures sur la reconnaissance des génériques autorisés. C’est une première. Le message est clair : ce n’est pas un simple générique. C’est une version exacte du médicament de marque. Et les patients méritent de le savoir.

Que faire si vous prenez un médicament de marque ?
Si vous êtes sous un traitement stable, et que vous avez déjà eu des réactions à un générique classique, demandez à votre médecin ou à votre pharmacien : « Est-ce qu’un générique autorisé existe pour mon médicament ? »
Voici comment vérifier :
- Consultez la liste officielle des génériques autorisés de la FDA : https://www.accessdata.fda.gov/scripts/cder/afg/index.cfm
- Recherchez le nom de votre médicament de marque (ex : Prolia)
- Si un générique autorisé apparaît, notez son nom commercial et son fabricant
- Demandez à votre pharmacie de le commander - il n’est pas toujours en stock
- Confirmez avec votre assurance qu’il est couvert
Les génériques autorisés ne sont pas une solution pour tout le monde. Mais pour les patients avec des maladies chroniques, des traitements à indice thérapeutique étroit, ou des réactions aux excipients, ils peuvent faire toute la différence.
Le futur des génériques autorisés
Les analystes prévoient que les génériques autorisés représenteront moins de 5 % des nouveaux génériques d’ici 2027. La loi RELIEF Act, proposée en mai 2025, pourrait forcer les laboratoires à aligner le prix des génériques autorisés sur celui des génériques classiques - ce qui les rendrait moins intéressants pour les marques. Mais cela pourrait aussi les rendre plus accessibles pour les patients.
Dr Aaron Kesselheim, de l’Université Harvard, le dit clairement : « Les génériques autorisés sont un outil de sécurité sous-utilisé. » Pour certains patients, ils ne sont pas une alternative. Ils sont la seule option pour rester en bonne santé.
Un générique autorisé est-il vraiment identique au médicament de marque ?
Oui. Un générique autorisé est fabriqué par le même laboratoire que le médicament de marque, avec exactement les mêmes ingrédients actifs et inactifs. La seule différence est l’étiquette et l’emballage. Il n’y a aucune variation dans la formule, la fabrication ou la qualité.
Pourquoi les génériques autorisés sont-ils plus chers que les génériques classiques ?
Parce qu’ils sont vendus par le laboratoire de marque lui-même, qui n’a pas besoin de réduire les prix pour concurrencer d’autres fabricants. Les génériques classiques, eux, viennent de plusieurs producteurs, ce qui crée une concurrence accrue et abaisse les prix. Un générique autorisé peut coûter 10 à 15 % moins cher que le médicament de marque, contre 70 à 80 % pour un générique classique.
Comment savoir si mon pharmacien me donne un générique autorisé ?
Demandez-le directement. Le nom du produit sur l’étiquette ne le dit pas toujours. Vérifiez sur la liste officielle de la FDA ou demandez à votre pharmacien de consulter le livre Orange. Si le nom du fabricant est le même que celui du médicament de marque, c’est très probablement un générique autorisé.
Les génériques autorisés sont-ils couverts par l’assurance ?
Cela dépend de votre plan. Certains assureurs les couvrent, d’autres non, car ils préfèrent les génériques classiques avec lesquels ils ont négocié des remises plus importantes. Vérifiez toujours votre liste de médicaments couverts (formulary) ou contactez votre fournisseur d’assurance.
Pourquoi la FDA n’a-t-elle approuvé que deux nouveaux génériques autorisés en 2025 ?
La pression de la FTC contre les pratiques anti-concurrentielles a forcé les laboratoires à abandonner cette stratégie. Les génériques autorisés étaient souvent utilisés pour bloquer l’entrée de génériques indépendants. Aujourd’hui, les laboratoires préfèrent développer des biosimilaires, qui sont mieux encadrés par la loi et plus rentables à long terme.
Commentaires (12)
- Arsene Lupin
- janvier 19, 2026 AT 15:00
Alors là, je suis scotché. Un générique autorisé, c’est juste de la triche marketing. Le labo garde le monopole, facture presque le prix original, et on nous dit que c’est ‘plus sûr’ ? T’as vu le prix du Xyrem en 2025 ? 800€ le flacon. Même avec ‘15 % moins cher’, c’est du vol organisé. La FDA est devenue la caisse de résonance des pharmas.
- Nathalie Tofte
- janvier 21, 2026 AT 13:33
Vous oubliez un point fondamental : un générique autorisé n’est pas un « générique » au sens juridique du terme. Il est approuvé sous NDA, pas ANDA. C’est une subtilité cruciale. La FDA ne l’appelle pas « générique » - elle le désigne comme « authorized generic ». La confusion terminologique induit des erreurs de perception chez les patients. Il faut arrêter de parler de « générique » quand on parle de version identique du laboratoire d’origine.
- Henri Jõesalu
- janvier 22, 2026 AT 05:45
oui mais bon les gens qui prennent du prolia ou du xyrem ils sont deja en galere avec leur maladie alors un truc qui marche pareil mais un peu moins cher c’est quand meme mieux non ? je veux dire… j’ai vu un pote qui a changé de générique et il a eu des crises de tremblements pendant 3 semaines… alors que le vrai il était calme comme une vache…
- Jean-marc DENIS
- janvier 22, 2026 AT 15:08
Je suis désolé, mais cette histoire de générique autorisé, c’est juste un nouveau stratagème pour garder les prix élevés. La FTC a raison de les traquer. Quand un labo lance son propre générique, c’est pour écraser les vrais concurrents. C’est du capitalisme de rente. Et les patients ? Ils paient la note. Même si c’est ‘identique’, le prix reste prohibitif. On nous prend pour des cons.
- Louis Stephenson
- janvier 24, 2026 AT 01:31
Je suis pharmacien de quartier. Je peux vous dire que les patients qui demandent un générique autorisé, c’est souvent ceux qui ont déjà eu un mauvais choc avec un vrai générique. Ils sont hyper contents quand on leur en trouve un. Le problème, c’est qu’on en a pas toujours en stock, et les assureurs refusent de les couvrir. Mais bon, si ça évite un hospitalisation pour réaction à un excipient, c’est pas cher payé.
- christophe gayraud
- janvier 25, 2026 AT 18:39
ET SI C’ÉTAIT UN PIÈGE ?!?!?!! Le laboratoire te donne un ‘générique autorisé’ pour te faire croire que c’est plus sûr… mais en réalité, ils changent les excipients en douce ! Ils sont obligés de déclarer le produit, mais personne vérifie les lots ! J’ai lu un rapport fédéral non publié qui disait que 30 % des ‘génériques autorisés’ avaient des variations de pureté ! La FDA est corrompue !
- Andre Esin
- janvier 25, 2026 AT 23:38
Le vrai problème, c’est que les pharmaciens ne sont pas formés là-dessus. J’ai vu un patient se faire remplacer un générique autorisé par un vrai générique parce que le pharmacien pensait que c’était pareil. Le patient a eu des nausées pendant une semaine. On a besoin de formations obligatoires, pas juste un module de 3h dans une école. Ce n’est pas un ‘générique’. C’est la même pilule. Point.
- jean-baptiste Latour
- janvier 26, 2026 AT 23:39
Alors moi j’ai testé le générique autorisé de Lyrica… et j’ai eu envie de pleurer tellement c’était la même chose 😭💸 Mais bon, 5€ de moins ? Pourquoi je ferais ça ? Mon assurance me le met à 10€ avec le vrai générique… Donc je reste sur le classique. C’est pas de la mauvaise foi, c’est de la logique de portefeuille 💼📉
- Xavier Lasso
- janvier 27, 2026 AT 19:14
Si tu es sous un traitement chronique et que tu tiens bien avec ton médicament de marque, demande le générique autorisé. C’est pas un luxe, c’est une sécurité. Je l’ai fait pour mon Prolia après une réaction à un générique classique - et j’ai dormi la première nuit depuis 6 mois. C’est pas magique, c’est juste que la formule est exacte. Ton corps ne fait pas de crise de sevrage. Essaye. Ça peut changer ta vie.
- Tim Dela Ruelle
- janvier 27, 2026 AT 22:37
Vous êtes tous naïfs. Les génériques autorisés sont un leurre. Les labos les utilisent pour faire du ‘greenwashing’ éthique. Ils disent ‘on vous protège’ alors qu’ils bloquent la concurrence. Et vous, vous les applaudissez parce qu’ils sont ‘identiques’. Identique ? Oui. Mais c’est toujours le même cartel qui contrôle le prix. C’est de la manipulation. Arrêtez de vous laisser berner.
- Fleur D'Sylva
- janvier 29, 2026 AT 19:15
Je me demande si ce n’est pas une question de confiance. Nous avons appris à craindre les variations dans les médicaments - et pourtant, la science nous dit que les excipients sont souvent sans effet. Mais la peur est plus forte que la logique. Peut-être que ce n’est pas la formule qui compte… mais la croyance qu’elle est inchangée. Et dans ce cas, le générique autorisé n’est pas un médicament. C’est un rituel de sécurité.
- mathieu ali
- janvier 30, 2026 AT 20:57
Oh mon Dieu, encore un article qui nous fait croire que les labos sont des anges. ‘Même formule !’ Oui, mais qui les fabrique ? Les mêmes qui ont fait payer 10 000€ le Xyrem en 2020. Et maintenant, ils nous disent ‘prenez notre version moins chère’… Comme si on devait leur dire merci. C’est pas un générique, c’est un chantage à la santé. 🙄
Poster un commentaire
Catégories
Articles populaires